ácido acético (Português)
definição
ácido acético é um ácido monocarboxílico ligeiramente corrosivo. Também conhecido como ácido etanóico, ácido metanocarboxílico, acetato de hidrogênio ou ácido etílico, este composto orgânico é usado na fabricação química, como um aditivo alimentar, e na produção de petróleo. A fórmula molecular do ácido acético é C2H4O2 ou CH3COOH, onde –COOH define a presença do único grupo carboxilo.,

Ácido Acético Estrutura
ácido Acético estrutura é a de um simples ácido carboxílico e consiste de um grupo metilo ligado a um grupo carboxilo, como visto na imagem abaixo. O ácido acético ou ácido etanóico é um solvente protético; é capaz de doar prótons na forma de hidratos (átomos de hidrogênio positivamente carregados)., Esta característica significa que é um membro do grupo ácido Brønsted onde prótons são doados a moléculas aceitadoras conhecidas como bases Brønsted. O hidrogênio doado é dissociado do grupo carboxilo. O vinagre é uma solução de ácido acético e água, onde cerca de 0,4% de ácido acético moléculas de desistir de sua H+ átomos, levando a uma solução ácida de aproximadamente 2,4 pH. Em comparação com o ácido mais forte do mundo – carborane ácido (H(CHB11Cl11)) – com um valor de pH de -18, ácido acético é levemente ácida, em comparação.,
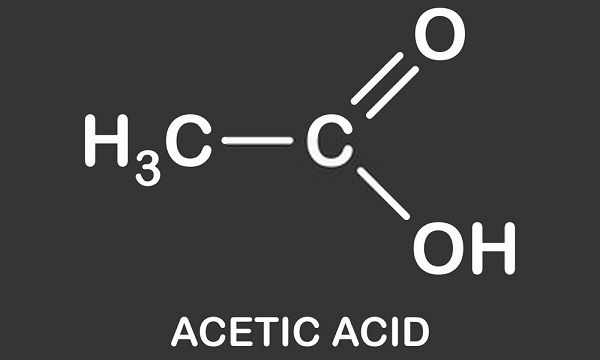
por Isso, deve ficar claro que não é a presença de um único átomo de hidrogênio, que altera o pH de uma solução. As soluções neutras (nem ácidas nem alcalinas) contêm um número equilibrado de íons hidrônio (H30+) e íons hidroxilo (OH–). Duas moléculas de água (H20) são formadas quando um íon hidrônio e hidroxila se ligam e as cargas positivas e negativas são canceladas., Quando o ácido acético é adicionado à água, ele se divide em um íon acetato carregado negativamente (CH3COO–) e H+. É, portanto, possível entender o nome alternativo de ácido acético-acetato de hidrogênio. Uma pequena percentagem de íons de hidrogênio positivamente carregados se ligam às moléculas de água e os transformam em H30+. Isto significa que há mais íons de hidrônio e, portanto, criar uma solução positivamente carregada (ou ácida). O pH de uma solução é, portanto, dependente do equilíbrio do hidrônio e hidroxil e não do número de íons de hidrogênio, embora estes afetem este equilíbrio., Um valor de pH também é dado apenas a uma solução. Uma solução sempre contém água; mesmo superácidos modernos como o carborano são dissolvidos em soluções aquosas concentradas de outros ácidos. Mesmo o ácido acético glacial tem uma pequena quantidade de água.a imagem seguinte mostra a dissociação do ácido acético com acetato na água. À esquerda estão uma única molécula de ácido acético e uma única molécula de água. Ácido acético passa sobre um íon de hidrogênio para a molécula de água para produzir um íon de hidrônio. Dizemos que a molécula de água é protonada ou teve um próton (Hidron) doado a ela.,
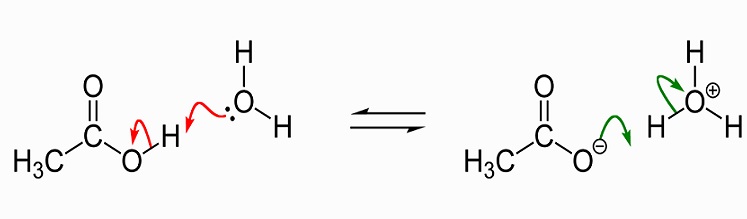
Como um solvente, líquido ácido acético dissolve polar (hidrofílica) compostos, tais como sais e açúcares e não-polares compostos que incluem as gorduras e óleos. Isto significa que tem muitos usos na produção química industrial, mas também ganhou uma reputação como um suplemento de perda de peso, uma vez que afeta o metabolismo de gordura e açúcar. Mais informações sobre os usos do ácido acético serão discutidas mais adiante neste artigo., Na forma cristalina, duas moléculas de ácido acético se unem com ligações de hidrogênio para formar um dímero. Quando a água é adicionada, estas ligações são quebradas e a forma cristalina se dissolve.

Ácido Acético Fórmula
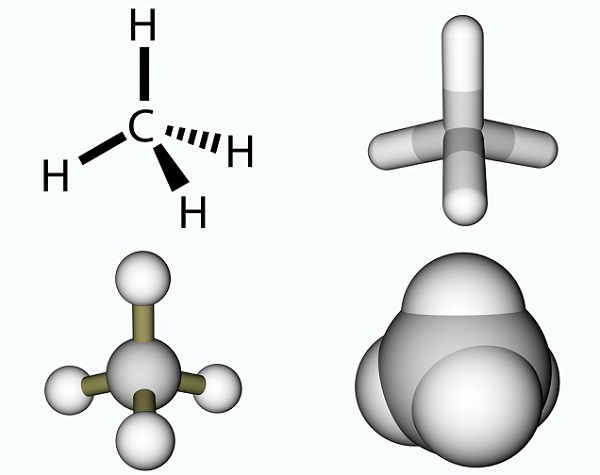
O ácido acético fórmula é simples e o resultado de um grupo metilo e um grupo carboxilo., Os grupos metila são um dos compostos orgânicos mais comuns no planeta, mas raramente são encontrados como entidades únicas. Eles são compostos de três átomos de hidrogênio e um átomo de carbono (CH3). Como o carbono tem quatro elétrons, o elétron livre geralmente se liga com outras moléculas por meio de uma ligação covalente. A molécula de carbono mais simples é o metano (CH4), bem conhecido por sua contribuição para o aquecimento global. Com um elétron livre, o metano reage com ozônio (O3) para produzir dióxido de carbono e água na seguinte reação: (3)CH4 + (4)O3 = (3)CO2 + (6)H2O., A imagem mostra uma molécula de metano composta por um grupo metil e um átomo extra de hidrogênio.
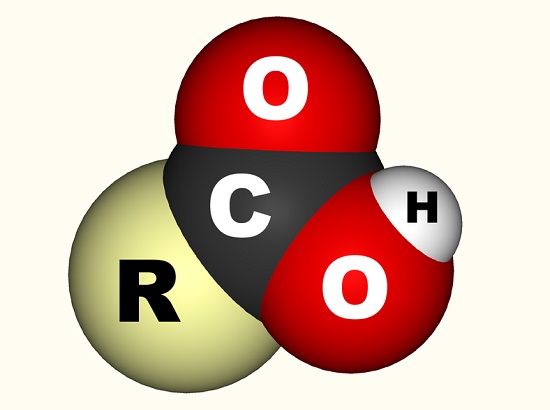
No caso do ácido acético, o elétron livre liga-se com um grupo carboxilo (CO2H, -COOH ou -C(=O)OH) o que é um único átomo de carbono ligado a um grupo hidroxila (-OH) e clique duas vezes ligado a um átomo de oxigênio., A imagem abaixo mostra um grupo carboxilo onde R representa o resto da molécula à qual o grupo carboxilo é anexado; a letra R é às vezes substituída por uma linha wiggly. No caso do ácido acético, o R representa o grupo metilo. Alguns preferem descrever o grupo carboxilo como uma combinação de um grupo carbonilo (c=0, onde = indica a dupla ligação) e um grupo hidroxilo (O-H). Ácidos carboxílicos são encontrados em aminoácidos e essenciais para todos os organismos vivos.,
em geral, a fórmula molecular, para todos os ácidos carboxílicos, nomeadamente CnH2n+1COOH. Isto significa que cada ácido carboxílico apresenta o dobro de átomos de hidrogênio como átomos de carbono uma vez que o grupo carboxilo é removido; uma fórmula que se encaixa perfeitamente com a do ácido acético – C2H4O2. Quando você remove o grupo carboxilo desta fórmula de ácido acético, você fica com um carbono e dois átomos de hidrogênio.,
ácido acético factos
ácido acético factos para aqueles que querem aprender um pouco mais!
a massa molar do ácido acético é de 60, 052 gramas por mol (g/mol). Massa Molar é a massa total de um elemento ou composto (massa atómica) medida em unidades de massa atómica ou “amu”, dividida pela sua quantidade em moles (mol). Um único Mol é baseado no número Avogadro 6.02214076×1023, pois este número significa que a comparação entre moles e Daltons, outra unidade científica de massa atômica, é mais simples.,
ácido acético Glacial é uma solução de ácido acético em uma quantidade muito pequena de água – menos que 1%. A palavra glacial refere-se à sua forma cristalina à temperatura ambiente. Outro nome para ácido acético glacial é ácido acético anidro. Esta forma é um ácido fraco, mas um veneno corrosivo, causando bolhas e queimaduras. Como há muito pouca água com a qual se dissociar, o ácido acético glacial irá passar seus protões para a água na pele ou membranas mucosas.,encontrar o agente tampão correcto para um ácido tal como o ácido acético requer conhecimento do pH, Ka ou pKa do ácido. O pH, O Ka e o pKa estão todos relacionados um com o outro. Ácido acético tem um Ka de 1,8 x 10-5 ou um mais fácil de calcular o valor de pKa de 4.756. O pH mede o número de íons de hidrogênio (H+) em qualquer solução que contenha água e varia de 0 (ácido) a 14 (base). Quanto menor o pH, maior a concentração de íons de hidrogênio. A Ka e a pKa relacionam-se com ácidos e relacionam-se com a constante de dissociação ácida que mostra a probabilidade de o ácido ceder os seus protões., Um Ka alto nos diz que um ácido é forte e reagirá a qualquer químico adicionado a ele. O pKa é o oposto-quanto menor o número, mais forte o ácido. Isto é porque o pKa é um logaritmo negativo do Ka.no entanto, o ácido acético concentrado pode ter um pH inferior ao ácido forte. Graças ao pKa, que é um valor constante, podemos fazer cálculos sem ter que pensar em concentrações. O pKa do ácido acético é 4.756 e isso nos diz O quanto é provável que ele desista de seus prótons em uma solução., As Bases são medidas de acordo com a probabilidade de removerem protões de uma solução.o ponto de ebulição do ácido acético situa-se entre 244 e 246°F (118 e 119°C) e o seu ponto de fusão situa-se entre 61 e 62°F (16 e 17°C) ou mesmo à temperatura ambiente. A densidade do ácido acético é de 1,049 g cm-3 em estado líquido, e 1,27 g cm−3 em estado sólido.a forma mais comum de ácido acético é o vinagre que contém 5-20% de ácido acético. Quão grande é a diluição (e, portanto, a resistência do ácido) é referida como a sua resistência ao grão., Você pode facilmente calcular isso multiplicando a concentração por 10. Vinagre contendo 5% de ácido acético terá uma resistência de grãos de 50.
as utilizações do ácido acético
ácido acético são muitas e variadas. Este ácido é usado na fabricação de bens, no processamento de alimentos, na indústria de limpeza, na medicina, e como um suplemento de saúde. O ácido acético é também um essencial bioquímico na forma de grupo acetilo, onde é fundamental para a construção de aminoácidos e, portanto, impossível de existir sem ele. Vamos dar uma olhada em alguns destes usos de ácido acético em mais detalhes.,o ácido acético é um reagente químico importante usado para produzir acetato, colas e tecidos sintéticos. O ácido acético também é usado em galvanoplastia, onde um revestimento metálico é depositado em um objeto, colocando-o em uma solução que contém um sal metálico específico. A solução precisa ser condutiva e ácidos que doam íons hidrogênio criam condições ideais. Além disso, a galvanoplastia só pode ocorrer dentro de uma solução e os sais metálicos só se dissolvem em soluções com um baixo valor de pH (ácido).,o ácido acético é uma matéria-prima utilizada na produção de acetato de celulose, anidrido acético (Plásticos) e ácido cloroacético utilizados na produção de corantes e pesticidas, bem como de certas drogas.ácido acético utilizado na transformação de alimentos para regular os níveis de acidez ou de alcalinidade dos alimentos. O Código Federal Regulations (CFR) classifica o ácido acético como um aditivo alimentar de uso geral que é seguro quando utilizado de acordo com as boas práticas de fabrico. Na Europa, os regulamentos relativos aos números electrónicos aplicam-se a todos os aditivos alimentares., O ácido acético recebeu o código E260 e é considerado um ingrediente seguro que controla a colonização bacteriana e pode ser usado sem limitação. Esta não é uma descoberta nova. Diz-se que os antigos babilónios usavam vinagre como conservante alimentar.vinagre é usado para produzir guarnições para salada, condimentos que incluem mostarda, ketchup e maionese, e em molhos e pickles.,o ácido acético para limpeza do ácido acético tem sido utilizado como produto de limpeza e desodorizante durante séculos, se não milênios; esponjas de vinagre foram colocadas em anéis filigranes caros usados pelos ricos sempre que atravessavam ruas imundas e fedorentas do século XVIII. As propriedades desodorizantes do vinagre também foram aproveitadas por gerações. Os marinheiros usavam vinagre para limpar os conveses dos navios onde trabalhavam e viviam., Os princípios do controle microbiano podem não ter sido compreendidos na época, mas as características de cheiro fresco, limpo e de prevenção de doenças desta solução orgânica eram definitivamente bem conhecidas.a adição de um produto alcalino ao ácido provoca uma reacção borbulhante e fibrosa. Alguns limpadores tradicionais acreditam que este efeito produz uma limpeza mais profunda a superfícies estáveis., Por exemplo, lavar o quintal com alcalina de soda cáustica (hidróxido de sódio) e, em seguida, usando uma mistura de vinagre em cima isso irá desencadear uma reação que, certamente, parece que ele tem uma profunda acção de limpeza; no entanto, isso faz muito pouco para aumentar a higiene efeito, mas, ao invés de buffers ou trabalha contra o poder de limpeza alcalina de soda cáustica com o ácido propriedades do vinagre.,hoje, muitos fãs dedicados de vinagre branco anunciam os benefícios ecológicos de usar ácido acético diluído para limpar casas de banho, lavar roupas, remover odores, e fazer superfícies de preparação de alimentos limpos e seguros. O ácido acético também remove os depósitos à escala de ferrugem e cal.
ácido acético em Medicina
ácido acético ou vinagre tem sido provavelmente usado em medicina desde antes da palavra escrita. Se você sofreu de uma ferida aberta na Ilha de Kos no século IV Antes de Cristo, você pode ter sido prescrito um banho diário de vinagre por Hipócrates., Se você tivesse uma dor de garganta, ele também poderia ter lhe pedido para misturar mel e vinagre para fazer Oximel, um antigo remédio grego para a tosse; se você tivesse servido na Europa durante a Primeira Guerra Mundial, você pode apenas ter tido acesso ao vinagre manter limpo e permanecer livre de infecção.
hoje em dia, as soluções de ácido acético são usadas em processos laboratoriais de análise de sangue como lavagem de lâminas. Eles removem biofilmes bacterianos em feridas e no sistema digestivo, e muitas vezes têm sido usados para infecções do ouvido externo e assim evitar o uso de antibióticos., A ingestão de vinagre aumenta os níveis de acetato no cólon e promove a captação de cálcio com menor pressão arterial e maior densidade óssea como resultado. Estudos estão investigando o uso do acetato como um medicamento antitumor.
ácido acético como um suplemento de saúde
ácido acético é um suplemento de saúde popular e consumido na forma de vinagre,mais comumente vinagre de maçã. Quando ligado à coenzima A, o grupo acetilo do ácido acético é central para o metabolismo dos hidratos de carbono e gorduras.,muito estudo foi feito sobre a relação entre o consumo de vinagre e os níveis mais baixos de glucose no sangue. Onde alimentos de índice glicêmico elevado são consumidos após a ingestão de duas a três colheres de sopa de vinagre de sidra de maçã, os seus valores glicêmicos têm mostrado ser até 35% mais baixos. Para os diabéticos, isto pode significar níveis mais baixos de glucose sanguínea pós-prandial e um melhor controlo glicémico e, para os não diabéticos, um menor risco de desenvolver resistência à insulina. A substituição do pepino regular por um pepino em conserva revelou uma redução de 30% do índice glicémico total das farinhas.,a imagem seguinte mostra o efeito dos alimentos com baixo e elevado índice glicémico (GI) nos níveis de glucose no sangue. Os alimentos GI elevados causam um pico rápido nos níveis de glucose no sangue que aumentam a produção de insulina, o que permite que as células metabolizem a glucose. Isto significa que o nível de Glicose no sangue mergulha rapidamente, causando fome. Os alimentos GI Baixos causam um aumento mais suave do açúcar no sangue e não forçam o pâncreas a produzir quantidades tão grandes de insulina. O resultado é uma curva suave que permanece estável e não mergulha, aumentando os níveis de saciedade após uma refeição., Quando um alimento GI elevado e um alimento GI baixo são comidos ao mesmo tempo, eles parcialmente cancelam um ao outro, criando um efeito platô. O vinagre é conhecido por ter o mesmo efeito que um alimento GI muito baixo.

Como já mencionado, o ácido acético também é considerado um suplemento de perda de peso, devido à sua capacidade para o nível de pico de glicose após as refeições e isso ajuda a aumentar a saciedade., Sugere-se também que a presença de ácido acético na dieta retarda o esvaziamento gástrico, o que também ajuda a controlar algumas formas de excesso de ingestão. Além disso, o vinagre parece desencorajar a formação de gordura em doses de apenas 15 mililitros por dia.